황산 바륨
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
황산 바륨은 냄새와 맛이 없는 백색 분말 또는 무색 결정으로, 물에 거의 녹지 않는 성질을 가진다. 석유 산업의 시추 유체 가중제, 백색 페인트 및 고무 제품의 충전제로 사용되며, X선 조영제로도 활용된다. 시추 유체의 밀도를 높여 폭발 가능성을 줄이고, X선 촬영 시 소화관의 모양을 나타내는 데 사용된다. 황산 바륨은 상업적으로 중정석을 탄소열 환원하여 제조하며, 가용성 바륨염과는 달리 인체에 무해하다.
더 읽어볼만한 페이지
- 조영제 - 리피오돌
리피오돌은 림프계 및 자궁난관 촬영 등에 사용되는 요오드화 에티오다이즈드유 조영제이지만, 아나필락시스 쇼크를 포함한 심각한 부작용을 유발할 수 있어 사용에 주의해야 하며, 특정 환자에게는 금지된다. - 바륨 화합물 - 이트륨 바륨 구리 산화물
이트륨 바륨 구리 산화물(YBCO)은 93K의 비교적 높은 임계 온도에서 초전도성을 나타내는 최초의 고온 초전도체 중 하나로, 액체 질소 끓는점 이상에서 초전도성을 보여 초전도 연구 및 응용에 중요한 물질이다. - 바륨 화합물 - 수산화 바륨
수산화 바륨은 화학식 Ba(OH)2를 갖는 강염기성 화합물로, 산화 바륨과 물의 반응으로 제조되며 옥타수화물 형태로 존재하고, 바륨 화합물 전구체, 약산 적정, 유기 합성 등에 활용되지만 부식성과 독성을 가지며 관련 법규에 따라 규제된다. - 황산염 - 황산 칼슘
황산 칼슘은 칼슘의 황산염으로 수화 정도에 따라 다양한 결정 구조를 가지며 건설, 식품, 치의학 등 여러 산업 분야에서 활용되는 광물이다. - 황산염 - 황산 나트륨
황산 나트륨은 다양한 형태의 이온성 황산염으로, 자연에서 광물로 산출되거나 화학적 공정의 부산물로 얻어지며, 제지, 유리, 섬유 산업 등에서 활용되고, 특히 십수화물은 글라우버염으로 불리며 완하제나 한약재로도 사용된다.
2. 성질
황산 바륨은 냄새와 맛이 없는 흰색 분말 또는 무색 결정이다. 물에 대한 용해도는 매우 낮으며, 산과 알칼리에도 잘 녹지 않는다. 염산과 함께 끓이면 일부 용해되며, 농황산에는 가열 시 산성염을 생성하여 녹는다. 이러한 황산 바륨의 난용성은 바륨 염 폐기물 속 바륨을 고정하는 데 이용된다.
2. 1. 화학적 성질
냄새와 맛이 없다. 백색 분말 또는 무색 판상 또는 주상 결정이다. 물에 극히 적게 녹으며, 용해도는 18℃에서 0.22mg/100mL, 100℃에서 0.4mg/100mL이다.산, 알칼리에도 거의 녹지 않지만, 염산과 함께 끓이면 일부 용해된다. 또한 농황산에는 가열 시 산성염 Ba(HSO4)2를 생성하여 녹는다. 이러한 황산 바륨의 난용성은 바륨 염 폐기물에 포함된 바륨의 고정에 도움이 된다.
수산화 바륨과 황산의 중화 반응을 통해 황산 바륨 침전을 생성할 수 있다. 반응식은 다음과 같다.
:
위 반응에서 중화 반응이 일어나면 황산 바륨이 흰색 침전물로 생성된다.
3. 용도
황산 바륨은 크게 두 가지 형태로 나뉜다. 하나는 중정석을 분쇄하여 만든 바라이트 분말이고, 다른 하나는 황화 바륨과 황산 나트륨의 복분해 반응으로 생성되는 침강성 황산 바륨이다.
바라이트 분말은 석유 산업에서 시추 유체의 가중제로 중요하게 사용된다. 침강성 황산 바륨은 "영구적인 백색"을 의미하는 프랑스어 "blanc fixe"에서 유래되었으며, 백색 페인트로 사용된다. 황산 아연과 함께 사용되어 리토폰이라는 백색 안료를 만들기도 한다. 리토폰은 황화물에 노출되어도 검게 변하지 않는 특징이 있다. 또한 침강성 황산 바륨은 골프공과 같은 고무 제품의 충전제로도 사용되며, 나노 입자 형태로는 폴리머의 물성을 개선하는 데 사용된다.
황산 바륨은 X선을 투과하지 않는 성질 덕분에 엑스레이나 소화관 조영 검사에 사용되는 조영제로도 활용된다. 의료용 조영제로는 2004년에 약 1,750만 명이 사용한 것으로 추정된다.
3. 1. 시추 유체
석유 산업에서 황산 바륨은 새로운 유정이나 가스정을 채굴할 때 시추 유체의 가중제로 사용되는 바라이트 분말 형태로 사용된다. 이는 유체의 밀도를 높여[5] 유정의 정수압을 증가시키고 폭발 가능성을 줄이는 역할을 한다. 전 세계 황산 바륨 생산량의 약 80%가 이러한 시추 유체의 구성 요소로 소비된다.3. 2. 방사선 조영제
현탁액 형태의 황산 바륨은 X-ray 영상 촬영을 위한 방사선 조영제로 자주 사용된다. 흔히 "바륨 식사"라고 불리는 위장관 영상 촬영에 주로 사용되며, 경구 투여하거나 관장을 통해 투여한다. 굵은 우유와 같은 용액에 미세 입자가 들어 있는 현탁액 형태로 사용된다. 중금속인 바륨의 수용성 화합물은 독성이 강하지만, 황산 바륨은 낮은 용해도 덕분에 인체에 흡수되지 않고 배출되어 안전하다. 또한, 과거에 사용된 토로트라스트와 달리 체내에서 쉽게 제거된다. 바륨은 원자 번호 (''Z'' = 56)가 높아 X-선을 효과적으로 흡수한다.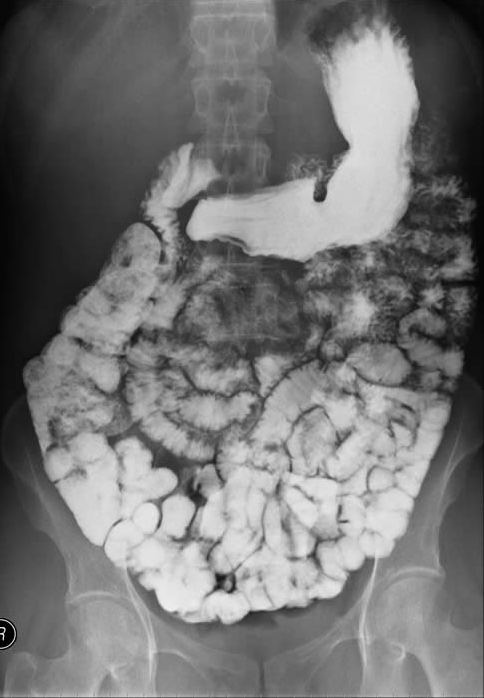
조영제는 X선을 잘 흡수하기 때문에, 황산 바륨을 내복하여 소화관의 모양을 X선으로 촬영할 수 있게 한다.[3]
3. 3. 안료 및 충전제
황산 바륨은 페인트, 플라스틱, 고무, 종이 등의 제조 과정에서 백색 안료 또는 충전제로 사용된다.- 페인트: 유화에서 황산 바륨은 거의 투명하며, 충전제 또는 점성 조절제로 사용된다.[5] 주요 유화 제조업체는 이산화 티타늄과 황산 바륨을 혼합한 "영구 백색"을 판매한다.
- 안료: 황산 바륨과 황화 아연의 조합은 리토폰이라는 무기 안료이다.
- 사진 인화지: 이미지의 반사율을 높이기 위해 대부분의 사진 인화지 기저 표면에 바라이트 층이 코팅된다. 최초의 사진 인화지는 1884년 독일에서 소개되었다.[8] 빛에 민감한 할로겐화 은 에멀젼이 바라이트 층 위에 코팅되며, 바라이트 코팅은 에멀젼이 종이 섬유 속으로 침투하는 것을 제한하고 에멀젼을 더욱 균일하게 만들어 균일한 검은색을 만든다.[9] 이미지 고정 및 보호를 위해 추가 코팅이 있을 수 있다.
- 잉크젯 프린터 용지: 잉크젯 프린터용 종이를 밝게 하는 데 사용된다.[10]
- 플라스틱: 진동 질량 감쇠 응용 분야에서 고분자 밀도를 높이기 위해 필러로 사용된다. 폴리프로필렌 및 폴리스티렌 플라스틱에서 최대 70% 비율로 사용되며, 산 및 알칼리 저항성과 불투명도를 높인다. X선 차폐 재료로도 사용된다.[11]
- 기타: HDPE의 재료 특성을 향상시키는 데 사용될 수 있지만, 탄산 칼슘 또는 산화 티타늄과 같은 다른 필러와 함께 사용되는 경우가 많다.[13] 골프공 등 다양한 고무 제품의 충전제로도 사용된다. 황산 바륨 나노 입자는 에폭시 수지 등 폴리머의 물성을 개선할 수 있다.
황산 바륨은 가시광선과 자외선을 모두 매우 반사하여[6] 태양 복사의 98.1%를 반사하는 페인트 성분으로 사용되어 페인트칠 된 표면을 햇빛 아래에서 더 시원하게 유지한다. 상업용 흰색 페인트는 태양 복사의 80~90%만 반사한다.[7]
3. 4. 기타 용도
황산 바륨은 토양 검사에 사용된다. 토양 pH 및 기타 토양 특성 검사에는 색상 지시약이 사용되는데, 토양의 작은 입자(보통 점토)가 검사 혼합물을 흐리게 하여 지시약의 색상을 보기 어렵게 만들 수 있다. 혼합물에 첨가된 황산 바륨은 이러한 입자와 결합하여 입자를 더 무겁게 만들어 바닥으로 가라앉혀 더 맑은 용액을 남긴다.색도 측정법에서 황산 바륨은 광원을 측정할 때 거의 완벽한 확산체로 사용된다.
금속 주조에서 사용되는 몰드는 용융된 금속이 몰드와 결합하는 것을 방지하기 위해 종종 황산 바륨으로 코팅된다.
황산 바륨은 브레이크 라이닝, 무향 폼, 분체 도장 및 근관(신경치료) 충전재에도 사용된다.
칠레 경찰청(Carabineros de Chile)에서 사용하는 "고무" 펠릿의 성분이기도 하다.[14] 이것은 실리카와 함께 펠릿이 96.5 쇼어 A 경도를 갖도록 돕는다.[14]
황산 바륨은 선택적으로 과도한 과도 환원에 민감한 작용기를 수소화할 때 촉매 지지체로 사용된다. 낮은 표면적을 가지므로 기질과 촉매의 접촉 시간이 짧아 선택성을 확보할 수 있다. 황산 바륨 위의 팔라듐은 로젠문트 환원 반응의 촉매로도 사용된다.
고온에서 가열하면 바륨 화합물이 특유의 녹색 빛을 내기 때문에, 바륨 염은 녹색 화약 배합에 자주 사용되지만, 질산염과 염소산염 염이 더 일반적이다. 황산 바륨은 "스트로브" 화약 조성물의 구성 요소로 흔히 사용된다.
황산 바륨은 높은 녹는점을 가지고 있고 물에 녹지 않기 때문에, 구리 양극판 주조 시 이형제로 사용된다. 양극판은 구리 주형에서 주조되므로, 액체 구리가 고체 구리 주형과 직접 접촉하는 것을 방지하기 위해, 미세한 황산 바륨 분말의 수현탁액을 주형 표면에 코팅제로 사용한다. 따라서 용융된 구리가 양극판 형태로 굳어질 때 주형에서 쉽게 분리될 수 있다.
황산 바륨은 물질의 높은 반사율과 거의 람베르트 특성 때문에 폴리테트라플루오르에틸렌 (PTFE) 외에도 적분구 내부를 코팅하는 데 사용되기도 한다.
4. 제조
상업적으로 소비되는 바륨은 대부분 불순물이 섞인 중정석에서 얻는다. 중정석은 탄소열 환원(코크스를 이용한 가열)이라고도 하는 열화학적 황산염 환원(TSR) 과정을 거쳐 황화 바륨이 된다.[5]
: BaSO4 + 4 C → BaS + 4 CO
황화 바륨은 물에 잘 녹으며 산화물, 탄산염, 할로겐화물 등으로 쉽게 바뀐다. 순도가 높은 황산 바륨을 만들기 위해 황화물이나 염화물을 황산 또는 황산염과 반응시킨다.[5]
: BaS + H2SO4 → BaSO4 + H2S
이렇게 만들어진 황산 바륨은 blanc fixe프랑스어라고도 불리는데, 이는 프랑스어로 "영구적인 흰색"을 뜻한다. 블랑 픽스는 페인트 등 소비재에 사용되는 바륨의 한 형태이다.[5]
실험실에서는 바륨 이온과 황산염 이온을 포함하는 용액을 섞어 황산 바륨 침전을 만든다. 황산 바륨은 물에 잘 녹지 않아 바륨 염 폐기물을 황산나트륨으로 처리하여 바륨을 고정(무독화)하기도 한다.[5]
5. 안전성
바륨염은 사람에게 적당히 독성이 있지만, 황산 바륨은 물에 거의 녹지 않아 인체에 흡수되지 않기 때문에 독성이 없다. 실수로 바륨 중독이 발생하는 가장 흔한 경우는 BaSO4로 잘못 표기된 가용성 바륨염을 섭취하는 것이다. 셀로바 사건(브라질, 2003)에서는 부적절하게 제조된 방사선 조영제를 사용하여 9명의 환자가 사망했다.[1]
직업적 노출과 관련하여, 미국 직업안전보건청(OSHA)은 허용 노출 기준을 15mg/m3로 정했으며, 미국 국립 산업안전보건연구원(NIOSH)은 권고 노출 기준을 10mg/m3로 정했다. 호흡기 노출의 경우, 두 기관 모두 직업적 노출 기준을 5mg/m3로 정했다.[1]
황산 바륨 화합물은 대부분 바륨 이온의 독성에 기인하여 극약 지정을 받고 있지만, 황산 바륨은 예외적으로 화학적으로 매우 안정하며, 바륨 이온이 용출될 우려가 없으므로 극약 지정에서 제외되어 있다.[2]
경구 섭취하는 조영제에서도 위액이나 장액에 전혀 용해되지 않고 소화기에서 흡수되지 않으므로, 바륨 이온에 기인하는 독성은 없다고 여겨진다. 그러나 후생노동성의 발표에 따르면, 의료용 황산 바륨 제제에는 부작용의 혐의가 있으며, 드물게 약물 과민증에 의한 쇼크 증상을 일으키거나, 또한, 그 높은 비중의 특성으로 인해, 대장 게실이나 변비 등으로 소화관의 동일한 부분에 머무를 경우 위장 천공을 일으키는 등의 중대한 증상을 나타낼 수도 있으며, 사망 예도 보고되고 있다.[2]
6. 역사
황산 바륨은 탄소에 의해 황화 바륨으로 환원된다. 수세기 전에 이러한 환원 반응이 우연히 발견되었고, 이는 최초의 합성 인광체 발견으로 이어졌다.[4]
20세기 초, 일본 식민지 시대에 타이베이시 근처 베이터우 온천 지역에서 호쿠토석이 발견되었다. 호쿠토석은 PbSO4와 BaSO4로 구성된 방사성 광물이며, 우라늄, 토륨, 라듐 등의 미량 성분도 포함하고 있다. 일본은 이러한 원소들을 산업용으로 채취했으며, 이 지역에 수십 개의 "온천 치료" 시설을 개발했다.[17]
참조
[1]
서적
CRC Handbook of Chemistry and Physics
https://archive.org/[...]
CRC Press
[2]
서적
Chemical Principles
Houghton Mifflin Company
[3]
문서
PGCH0047
[4]
서적
Inorganic Chemistry
Academic Press
[5]
서적
Ullmann's Encyclopedia of Industrial Chemistry
[6]
웹사이트
World's whitest paint is now thin enough to coat and cool down cars, trains and planes
https://www.zmescien[...]
2022-10-04
[7]
웹사이트
Purdue record for the whitest paint appears in latest edition of 'Guinness World Records'
https://www.purdue.e[...]
2021-09-16
[8]
문서
Silver Gelatin. The Atlas of Analytical Signatures of Photographic Processes
J. Paul Getty Trust
[9]
문서
Nanette L. Basic Photographic Materials and Processes
Taylor & Francis US
2008-10-27
[10]
간행물
Inkjet papers that will give your photos pizzazz: are you and your clients bored with your photo prints? check out our favorite fine-art and specialty inkjet papers that are sure to make your images stand out.
Web
2012-07
[11]
논문
Light Weight, Easy Formable and Non-Toxic Polymer-Based Composites for Hard X-ray Shielding: A Theoretical and Experimental Study
2020-01-28
[12]
논문
Light Weight, Easy Formable and Non-Toxic Polymer-Based Composites for Hard X-ray Shielding: A Theoretical and Experimental Study
2020-01-28
[13]
논문
Effect of Barium Sulfate Nanoparticles on Mechanical Properties and Crystallization Behaviour of HDPE
2010
[14]
뉴스
Investigación U. de Chile comprueba que perdigones usados por Carabineros contienen solo 20 por ciento de goma
https://www.uchile.c[...]
2019-11-18
[15]
뉴스
Is a firearm illegal if it is made out of plastic?
https://www.atf.gov/[...]
2016-09-23
[16]
논문
Barite-silica mineralization at the inter-Ordovician unconformity in southwestern Sardinia (Italy): a fluid inclusion study
2003-02-01
[17]
논문
Radioactive Disequilihrium of Uranium and Thorium Nuclide Series in Hot Spring and River Water from Peitou Hot Spring Basin in Taipei
2000
[18]
웹사이트
Barium Sulfate
https://www.cdc.gov/[...]
Centers for Disease Control and Prevention
2011-04-04
[19]
서적
CRC Handbook of Chemistry and Physics
CRC Press
2004
[20]
서적
Chemical Principles 6th Ed.
Houghton Mifflin Company
[21]
서적
The Elements, in Handbook of Chemistry and Physics 81st edition
CRC press
[22]
서적
Medicinal applications of coordination chemistry
https://books.google[...]
Royal Society of Chemistry
[23]
웹사이트
硫酸バリウム
http://www.jpo.go.jp[...]
특허청
2012-04-02
[24]
문서
Ullman 2007
[25]
웹사이트
医薬品・医療機器等安全性情報219号
https://www.mhlw.go.[...]
厚生労働省医薬食品局
2023-10-21
[26]
문서
日本工業規格 JIS K0400-41-40
https://www.jisc.go.[...]
日本工業標準審査会
[27]
서적
CRC Handbook of Chemistry and Physics
https://archive.org/[...]
CRC Press
[28]
서적
Chemical Principles
https://archive.org/[...]
Houghton Mifflin Company
[29]
문서
PGCH0047
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com

